汚れのない水準:パーソナルケア用品と化粧品における汚染防止を極める
「パーソナルケアマガジン」2025年6月号に掲載された記事を基にしています。

再現可能で明確な手順を確立し、異なるオペレーター間で視覚的な清潔さの評価に確実に合格できるようにしましょう。
たった一度の洗浄ミスで、わずか数日でブランドの評判が傷ついた様子を想像してみてください。除染・除菌(C&S)手順の単純なミスから、消費者に警告しなくてはならない製品のリコールとプレスリリース、正式な根本原因の分析、是正措置計画、その他多くの責務に直面することになります。財務面のコストと評判に関わるコストは莫大であり、FDA の調査結果が負担にさらなる拍車をかけています。適切な C&S 管理があれば簡単に防げたはずの問題を修正するために、これまでに数時間、数日、あるいは数週間を費やしてきました。化粧品の世界では、設備をピカピカに磨くことは、コンプライアンスだけでなく、消費者の信頼と衛生を守ることにもつながります。
ほとんどの場合、世界中の規制により、パーソナルケア用品や化粧品は混入や汚染がない状態を保つことが義務付けられています。メーカーは、汚染が発生しないように製造工程における重要なステップを管理することで、これらの規制を満たさなければなりません。製造・包装工程、除染工程、従業員の衛生管理、工場の衛生管理、原材料の管理、従業員の研修など、さまざまな統制を実践することができます。化粧品近代化規制法(MoCRA)の現行適正製造基準(cGMP)の草案の発表はまだ保留中であり、それに伴い、何が必要で、何が必要でないかについての憶測が飛び交っています。化粧品の GMP の国際規格である ISO 22716:2007 は、MoCRA GMP の草案の文言に影響を与える可能性のあるガイドラインの指標として参照できます。例えば、ISO 22716:2007 - 4.10.3 および 4.10.4 では、有効性が検証され、各施設エリアの特定のニーズに応じて選択および適用される特定の除染および/または消毒剤が要求されています。つまり、施設の様々なエリアで異なる除染の標準作業手順(SOP)が必要となる場合があり、それぞれの標準作業手順書の有効性を検証する必要があります。別の例として、ISO 22716:2007 - 7.2 は、他の要件の中でも、文書化、トレーサビリティ、品質チェック、バッチ管理の重要性を概説しています。これは、業界が「First Time Right」(FTR:初回で完璧に)の価値体系に移行し、運用が監査に対応して、製品が仕様どおりに製造および提供されるよう保証することを概説しています。
最終的に、これらの cGMP ガイドラインは、汚染リスクを軽減し、企業が安全で高品質の製品を消費者に届けているという自信を与えるうえで役立ちます。新しい GMP は、最初は威圧的に感じられることを認識する必要があります。この記事では、C&S が GMP の主な要素であることを考慮し、重要な処理設備の除染手順に関連するリスクとベストプラクティスを大まかに説明します。
汚れた設備のコスト
私たちが暮らしているデジタルで接続された世界では、製品の「欠陥」が消費者の手に渡ると、数日のうちにソーシャルメディアを通じて企業のブランドに悪影響を与える可能性があります。同様に、規制当局による監査結果やリコールの報告は、ブランドイメージを損なう恐れがあります。これらの欠陥や監査結果には、不適切な除染による前回の製造からの残留物や、微生物汚染による風味や粘度の変化など、多くの原因が考えられます。製造業者は、最終的に製品汚染のリスクを最小限に抑えられるよう、洗浄を行います。汚染の種類には、製品の交差汚染、活性剤の交差汚染、微生物汚染、さらにはクリーニング製品からの汚染などがあります。このようなリスクを考えると、製品の安全と品質を確保するために必要な清潔さの基準を理解することは非常に重要です。このことから、「どの程度の清潔さなら十分なのか」という疑問が浮かび上がってきます。
清潔とみなされる基準とは
汚染を回避するためにどの程度洗浄するかは主観的であり、その解釈に違いがあります。議論のために、除染のレベルは、見た目の清潔さ、残留物の清潔さ、微生物学的な清潔さの 3 段階で評価できると考えてください。これらの清潔さのカテゴリーは相互に関連しつつ、それぞれが異なるレベルで消費者リスクを引き起こします。消費者の安全確保を担う規制機関は、いくつかのガイドラインを示しています。以下の項では、各レベル、関連するリスク、および考えられる解決策について説明します。
1. 見た目の清潔さ
ISO は、ISO 22716 - 2007:化粧品 - 適正製造基準(GMP)2 において、「視覚的な清潔さ」について言及した業界向けの除染基準を示しており、除染とは「表面から一般的に目に見える汚れを分離し、除去すること」と説明されています(2.8 項)。この基準では、機器の表面からすべての目に見える汚れを除去するように指示しています。
あらゆる種類の汚染の中で、この基準は達成と確認が最も簡単であるように思われますが、実際には常にそうとは限りません。「基本状態」または「開始点」の定義はあいまいです。例えば、タンクにシミや汚れがあったり、何らかのダメージがあり、新品の頃のステンレスの美しい銀色の輝きを誰も思い出せない場合はどうでしょう。どのように視覚的に清潔な基準を確立するのでしょうか?タンクの修復や不動態化は、機器を「基本状態」または新品同様の外観に戻すために行われます。あるいは、検査(残留物、微生物)とリスク評価を通じて、品質グループと製造グループで、現在のベストな状態と新たな基準値を一致させることもできます。
では、見た目の清潔さはどのようにして測定できるのでしょうか?「見た目の清潔さ」は、手順、標準化、場合によっては調整を必要とする試験方法です。ここでは、視覚的に清潔とされるものを定義するのに役立つ 3 つの重要な変数、つまり光の状態、表面の状態、測定機器について見ていきましょう。
照明、または光の不足は、表面がはっきりと見えるかどうかに影響しがちです。したがって、C&S 検査手順には、光源、電球の種類、照射角度などを指定する照明の定義を含める必要があります。電球の状態は時間の経過とともに劣化するため、光源のメンテナンスも必要になる場合があります。光源の予防メンテナンス計画が必要になることもあります。
検査する表面の状態も重要です。たとえば、濡れた表面は乾いた表面とは異なって見え、土壌残留物の存在が見えにくくなることがあります。したがって、検査手順では表面の状態、つまり検査対象が濡れているか乾いているかを指定する必要があります。
オペレーターは、視覚的な清潔さの評価における主要な「機器」またはテスト機器となります。オペレーターは、評価試験を実施できる能力があると査定されているか、資格要件を満たしている必要があります。視力、矯正レンズ、および色を識別する能力は、視覚的な清潔さを評価する技術者の資格を判定する上で非常に重要です。適格性が確立されたら、技術者は、文書化された手順に従って適切な検査の手法についてトレーニングを受ける必要があります。
これらの手順要件が定義されたら、テストの合格基準を設定します。数値的なテスト結果は視覚的評価に結び付けられていないため、合格基準に対する一貫した測定を保証するには、視覚的な基準が必要です。これは多くの場合、許容できる外観と許容できない外観の写真で作成された視覚的基準によって達成されます。クリーニングのたびに、その結果を文書化する必要があります。これらの目視基準は、目視試験を実施するために複数の資格のあるオペレーターを擁することに伴うリスクの軽減に役立ちます。これらの手順を保管するには、紙ベースおよびデジタル形式を使用できますが、デジタル形式を利用することには多くの利点があります。これらの利点には、オペレーターにとってよりインタラクティブで集中できるトレーニング体験、監査準備のための充実した文書化と履歴データのトレーサビリティが含まれますが、これらに限定されません。
2. 過度な残留物がない
機器が「見た目の清潔さ」の基準に沿って洗浄されていても、目に見えないレベルの残留物が存在すると、消費者の安全に影響を与える可能性があります。たとえば、日焼け止めの化学薬品成分など、視覚的に検出できない有効成分もあります。また洗剤は、すすぎが十分でないと製品の品質に影響を与える残留物が残る可能性があり、目視検査では検出できないことがあります。
検出可能なレベルの製品、活性剤、洗浄剤をすべて除去して表面を清潔に保つことは、過度の時間と水が必要になる可能性があるため、メーカーにとって経済的ではありません。業界によっては、規制当局がリスクベースのアプローチを採用し、残留物をお客様が使用できる「安全なレベル」まで減らすよう求める場合があります。多くの場合、その「安全なレベル」とは毒性学的評価に基づいており、次のバッチに持ち越される残留量が、観察できる程度の影響や有害事象を発生させるレベルをはるかに下回ることを保証します。 そのためには、存在する可能性のある残留物、安全で許容可能な残留物レベル、残留物レベルを確認する試験方法、そして製品、活性剤、洗浄剤をその安全レベルまで確実に除去する除染プロセスを知る必要があります。化粧品メーカーは自社製品の製法を把握しているため、残留物として残る可能性のある活性剤や配合成分、関連する活性や毒性を理解しています。メーカーは通常、有効成分の試験方法をすでに開発しており、最終的な配合をテストして仕様の範囲内であることを確認しています。除染後のわずかな量の残留活性物質を正確に測定するには、その試験方法を検証または変更する必要があります。全有機炭素(TOC)試験法などの非特異的な試験では通常、非活性の製剤成分が除去されていることを確認できます。
化粧品メーカーにとって、より大きな未知の要素は除染洗浄剤かもしれません。信頼できるサプライヤーであれば、洗浄剤の毒性に関する情報や、残留物の有無を確認するための適切な試験方法を共有することができるでしょう。業界内では、試験方法は、毒性リスク評価に基づいて、特異的(特定の化学成分を識別する)または非特異的(残留物の存在を示すが、特定の化学物質は示さない)のどちらかになります。多くの場合、化粧品用途に使用される洗剤はリスクが低く、非特異的な方法でテストできます。例としては、全有機炭素(TOC)、導電率、pH などが挙げられます。いずれの場合も、非特異的分析法の結果から実際の残留レベルまでの相関関係や変化を調べるために、ラボでの作業が必要となります。開発には、洗浄剤メーカーのサポートが必要です。
隠れた汚染物質を除去するには過度な残留物がない状態を達成することが欠かせませんが、製品の安全を損なう可能性のある微生物の脅威に対処することも同様に重要です。ここで、機器が微生物学的に清潔であることを保証するという、清潔さの最終レベルに到達します。
3.微生物学的にクリーン
化粧品業界では、機器内のバイオバーデンによる微生物汚染がより大きな関心事となりつつあります。微生物汚染を抑制するための選択肢を模索する前に、用語を明確にする必要があります。グローバルな領域を混乱させる 2 つの用語 ー 殺菌と消毒。EPA および USP 基準では、微生物負荷の低下を除菌と呼び、消毒は微生物を破壊する、または不可逆的に不活性化することと定義しています。この記事では、殺菌という用語を、利用の地理的な場所に関係なく、微生物負荷を必要なレベルまで下げることとして使用します。
目視による清潔度と残留物レベルの基準が満たされたとしても、化粧品を汚染する可能性のある微生物が機器に残留する可能性は残ります。生物膜の存在を示すヌルヌルした変色部分があり、微生物コンタミネーションが極端な場合は、目視検査で問題を発見することができます。多くの場合、微生物汚染は最終製品の検査によってのみ検出され、微生物数が多いとバッチごと不合格になります。施設で製造された製品に微生物汚染の問題がこれまでなかったとしても、現在の製品トレンドはより天然成分へと移行しており、これまで見たことのない微生物群が混入する可能性が高まっています。さらに、EU が化粧品に使用できる防腐剤をリストから削除するにつれて、防腐剤の選択肢が狭まり、微生物の増殖や汚染への対抗手段が少なくなっています。

適切な除染と除菌の手順がなければ、機器は微生物の増殖のリスクにさらされ、機器内部にバイオフィルムとして現れる可能性があります。
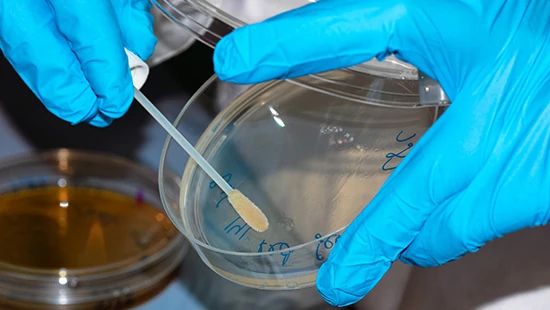
マイクロスワブは、残留微生物を検査する一般的な方法の 1 つです。
残留微生物は、機器の設計と状態に応じて、マイクロスワブまたはすすぎ水のサンプリングで測定することができます。残留微生物の検査には、主にサンプルポイントへのアクセスに関連する特有の課題があります。多くの場合、機器内で微生物増殖のリスクが最も高い場所は、パイプ、機器の継ぎ目、時には、えぐれや孔食によって損傷した機器表面など、容易にアクセスできない領域です。サンプル採取のためにアクセスするのが難しいこれらの場所はまた、効果的に消毒するのが最も難しく、そのことがリスクをさらに高めています。
洗浄した機器に残留する微生物を抑制する主な方法は、除菌です。パーソナルケア用品や化粧品のメーカーは、これまで微生物の残留を減らすために熱消毒を行ってきました。上記のような調合の傾向により、製造装置内の微生物管理を良好に保つことの重要性が高まっています。コストを抑え、エネルギー使用量を削減するというさらなる圧力により、企業はよく使われる温水殺菌から化学品を使った除菌へと移行しつつあります。熱処理プロセスが効果的で有効に作用するかどうかは、機器が接触するすべての場所の温度と時間に大きく依存します。特定の製品、濃度、接触時間(多くの場合は常温で数分間)で、確実な微生物学的効果が立証され、有効性が証明されている化学薬品による殺菌が、より一般的になってきています。
まとめ
パーソナルケア用品や化粧品が汚染のない環境で製造されるよう徹底することは、消費者の衛生と安全にとって不可欠です。メーカーが実践すべき重要なステップのひとつは、製造から汚染物質を効果的に除去する洗浄・除菌プログラムを考案することです。使用する製品(活性剤かどうかにかかわらず)や洗剤の残留物、あるいは微生物負荷が汚染物質になる可能性があります。「視覚的に清潔」な基準に沿った洗浄は必要不可欠であり、出発点として妥協は許されません。基準(プロセス、許容条件、トレーニング)の策定は非常に重要です。
ここまで、「見た目の清潔さ」だけでは不十分であるという事実を探ってきました。活性剤の残留物、洗浄剤の残留物、微生物バーデンなど、目に見えない残留物は汚染の原因となり、製品の品質に影響を与える可能性があります。洗浄・除菌プログラムでは、製品の品質が影響を受けていないという確信を得るために、これらすべての種類の残留物に厳密に対処する必要があります。
製品が最高レベルの清潔さと安全基準を満たすようにするには、汚染防止の専門家との提携をご検討ください。そうすることで、ブランドの評判を守り、消費者の健康を保護して、規制要件の先手を打つことができます。汚染の問題が起きるのを待つのではなく、今すぐ積極的な対策を講じて、確実な除染・除菌プログラムを実践しましょう。

生産現場における課題の克服
エコラボは、お客様のパーソナルケア用品の製造プロセスを最適化できます。
時間と費用を大幅に節約しましょう。
参考文献
- EU GMP ガイドラインの附属書 15 は次のように述べています。「製品残留物のキャリーオーバーの制限は、毒性学的評価に基づくべきである。選択した制限の正当性は、すべての裏付けとなる参照情報を含むリスク評価に文書化する必要があります」。
- 出典:https://www.epa.gov/pesticide-registration/pesticide-registration-manual-chapter-4-additional-considerations
- 出典:USP 第 1072 章



